Ацикловир детям при инфекции вирусной
Герпесвирусные инфекции у детей герпесвирусные инфекции вирус простого герпеса вирус ветряной оспы вирус опоясывающего герпеса вирус Эпштейн-Барр Е цитомегаловирус герпетическая инфекция заражение генитальный неонатальный герпес генерализованный герпес энцефалиты герпес кожи и слизистых гингивостоматиты герпетиформная экзема Капоши первичный герпес кожи герпетический панариций кератиты инфекционный мононуклеоз лимфома Беркитта назофарингеальная карцинома лейкоплакия неходжкинскя лимфома ацикловир противоцитомегаловирусный иммуноглобулин иммуномодулирующая терапия
Герпесвирусные инфекции у детей
С.А. Крамарев. доктор медицинских наук, профессор, заведующий кафедрой детских инфекционных болезней Национального медицинского университета им. акад. А.А. Богомольца.
Шлавный детский инфекционист Министерства Здравоохранения Украины
Герпесвирусные инфекции - группа инфекционных заболеваний, которые вызываются вирусами из семейства Herpesviridae, могут протекать в виде локализованных, генерализованных, рецидивирующих форм болезни, имеют способность к персистированию в организме человека и отнесены Комитетом экспертов ВОЗ к СПИД-индикаторным болезням.
Герпесвирусные инфекции (ГВИ) относятся к наиболее распространенным вирусным болезням человека. Инфицирован-ность и заболеваемость ими каждый год возрастает. Во всех странах мира 60-90% населения инфицированы тем или иным герпесвирусом. Герпесвирусы в своем составе содержат двунитчатую ДНК, имеют глико-липопротеиновую оболочку. Размеры вирусных частиц от 120 до 220 нм. На сегодня описано 8 типов герпесвирусов, которые выявлены у человека: два типа вируса простого герпеса (HSV-1, HSV-2), вирус ветряной оспы и опоясывающего герпеса (VZV или HHV-3), вирус Эпштейн-Барр (ЕBV или HHV-4), цитомегаловирус (CMV или HHV-5), HHV-6, HHV-7, HHV-8.
На основе биологических свойств вирусов сформированы 3 подсемейства герпесвирусов: ( a-герпесвирусы, b-герпесвирусы и g-герпесвирусы). К a-герпесвирусам относятся HSV-1, HSV-2, VZV. Вирусы этого подсемейства характеризуются коротким циклом репродукции с цитопатическим эффектом в клетках инфицированных культур. Вирусы быстро распространяются в клетках, преимущественно в нейронах, вызывают разрушение пораженных клеток, способны вызывать латентные формы.
Варицелла-зостер-инфекция
Varicella-zoster вирус вызывает ветряную оспу и опоясывающий герпес. Источником инфекции при ветряной оспе может быть только человек, больной ветряной оспой или опоясывающим герпесом, включая последние 24-48 часов инкубационного периода. Реконвалесценты ветряной оспы остаются заразными на протяжении 3-5 дней после прекращения высыпаний на коже. Через третье лицо заболевание не передается. Возможно внутриутробное заражение ветряной оспой в случае заболевания беременной. Ветряная оспа может встречаться в любом возрасте, но в современных условиях максимальное количество больных приходится на детей в возрасте от 2 до7 лет. Опоясывающий герпес развивается после первичного инфицирования вирусом Varicella-zoster, после перехода инфекции в латентную форму, при которой вирус локализуется в спинальных, тройничном, сакральном и других нервных ганглиях. Возможна эндогенная реактивация инфекции. Сдерживают реактивацию вируса факторы клеточного иммунитета.
Приобретенная CMV-инфекции может протекать в виде изолированного поражения слюнных желез. Характерным проявлением CMV-инфекции является интерстициальная пневмония. Начальными проявлениеми CMV-инфекции может быть гепатит, гематологическая патология: тромбоцитопения, гемолитическая анемия. Редким проявлением CMV-инфекции у иммуноскомпрометированного ребенка является поражение ЦНС, которое проявляется в виде подострого энцефалита, который иногда имеет волнообразное, рецидивирующее течение. В ряде случаев при CMV-инфекции наблюдается поликистозное перерождение поджелудочной железы с клиническими симптомами панкреатита или муковисцидоза. Поражение мочевыделительной системы может проявляться интерстициальным нефритом, циститом, адреналовой недостаточностью.
Инфекции, вызванные шестым, седьмым и восьмым типами герпесвирусов Герпесвирусы шестого типа (HHV-6) могут явиться причиной эритематозной и розеолезной сыпи (внезапная экзантема), поражений ЦНС и костного мозга у иммуноскомпроментированных детей. Герпесвирусы седьмого типа (HHV-7) вызывают экзантему новорожденных, а вирусы восьмого типа (HHV-8) - саркому Капоши и болезнь Кисельмана.
Для подтверждения диагноза в настоящее время широко используются современные лабораторные методы, такие как определение специфических иммуноглобулинов (IgM и IgG), иммуноферментный анализ, определение ДНК вирусов в биологических субстратах методом полимеразной цепной реакции, ДНК-гибридизации.
Лечение герпесвирусных инфекций
I этап - лечение в остром периоде заболевания или во время рецидива.
Открытие и внедрение в 1982 г. в клиническую практику ацикловира значительно повысило эффективность лечения ГВИ. Ацикловир подавляет синтез вирусной ДНК. Его селективное действие связано с образованием герпесвирусом в клетках трифосфата ацикловира, который блокирует вирусную ДНК-полимеразу. Концентрация ацикловира в инфицированных клетках в 100 раз выше, чем в неинфицированных. На сегодня доказана наибольшая эффективность ацикловира при HSV 1-2 и VZV. Наряду с ацикловиром при ГВИ наиболее часто применяются следующие препараты: Применение ацикловира при герпетических и зостер-энцефалитах снизило летальность с 50-80% до 10-15%, а неблагоприятные, инвалидизирующие последствия заболевания стали встречаться на 60-80% реже. Дозы и схемы лечения герпесвирусных энцефалитов представленны ниже.
Герпетические энцефалиты. В докоматознай стадии - ацикловир 10 мг\кг массы тела 3 раза в сутки на протяжении 10 дней внутривенно в коматозной стадии - 10-20 мг\кг массы тела 3 раза в сутки 14-21 день внутривенно. Затем по 200-400 мг 5 раз в сутки per os 14-21 день.
Энцефалиты при ветряной оспе. При мозжечковом энцефалите без общемозговых симптомов - ацикловир 10 мг\кг массы тела 3 раза в сутки 7-10 дней в случае энцефалита с выраженными общемозговыми симптомами (нарушение сознания, судороги) - 15-30 мг\кг массы тела 3 раза в сутки 10-14 дней. Затем ацикловир 200-400 мг 5 раз в сутки per os 14 дней. Пероральное применение ацикловира эффективно на ранних стадиях первичного герпетического гингивостоматита. Его использование с 1-3 дня от начала заболевания в дозе 600 мг на м 2 тела ребенка или по 200-400 мг 5 раз в день (у детей до 2 лет доза уменьшается в 2 раза) на протяжении 10 дней дает полное клиническое выздоровление. Быстро также ликвидирует симптомы заболевания назначение ацикловира при рецидивах гингивостоматитов у детей.
Использование ацикловира в первые 24-72 часа от начала симптомов опоясывающего герпеса дает выраженный клинический эффект. Но, учитывая то, что VZV менее чувствителен к ацикловиру, доза последнего увеличивается. При тяжелых формах опоясывающего герпеса в первые 4 дня ацикловир вводится внутривенно в дозе 20 мг на кг массы тела 3 раза в день, затем назначают препарат per os в дозе 800 мг 5 раз в день на протяжении 10 дней. При легких и среднетяжелых формах заболевания ацикловир применяется per os по 800 мг 5 раз в день в течение 5-7 дней. Некоторые преимущества по сравнению с ацикловиром при лечении ГВИ имеет валцикловир, благодаря намного большей биодоступности и более продолжительному периоду полувыведения из организма, что дает возможность уменьшить дозу препарата и кратность его введения. При инфекциях, вызванных вирусом простого герпеса, валцикловир применяется по 500 мг 2 раза в день, при опоясывающем герпесе - по 1000 мг 3 раза в день на протяжении 5-10 дней. К сожалению, дозы валцикловира для детей не разработанны, поэтому он рекомендован детям старше 12 лет. Тяжелые генерализованные формы ЦМВИ нуждаются в использовании комплекса противовирусных препаратов по следующей схеме: ганцикловир 5 мг\кг массы тела 2 раза в сутки внутривенно в течение 10-21 дня, затем препарат следует принимать перорально 1000 мг 3 раза в сутки еще 21 день.
Дополнительно назначают противоцитомегаловирусный иммуноглобулин внутримышечно 2 дозы каждый день на протяжении 5 дней, а потом по 2 дозы 1 раз в 5 дней до исчезновения клинических симптомов заболевания. При первичной ГВИ лечение больных заканчивается на первом этапе лечения. При рецидивирующей - переходят ко второму этапу.
II этап - лечение в стадии ремиссии.
На втором этапе лечения изменяется тактика этиотропной терапии путем перехода на пролонгированный прием ацикловира по 0,1-0,2 г в день на протяжении 2-12 месяцев в зависимости от тяжести заболевания.
Иммунотропная терапия. В соответствии с современными взглядами на иммунопатогенез рецидивирующих инфекций, применение иммуномодуляторов целесообразно начинать на втором этапе лечения, после достижения относительной ремиссии патологического процесса. Указанные особенности тактики иммунокоррекции обусловленны необходимостью исключения дополнительных антигенных нагрузок на этапе острого инфекционного процесса (первый этап лечения), так как при этом иммунный ответ носит признаки стрессового реагирования. Использование в этом периоде препаратов, которые десенсибилизируют лимфоциты или обеспечивают рефрактерность макрофагов к активирующим стимулам, препятствует полноценной реализации вирулицидного и бактерицидного потенциала и формирует угрозу возникновения рецидивов после окончания лечения. В период нестойкой ремиссии - на 12-14-й день от начала рецидива герпетической инфекции- иммунологический ответ приобретает признаки сбалансированности, которая разрешает осуществлять лабораторные обследования и определять целесообразность и характер иммуномодулирующей терапии. Целью иммуномодулирующей терапии при рецидивирующих ГВИ является активация клеточного иммунитета и его коррекция.
Таким образом, включение препаратов с иммуномодулирующими свойствами в состав комплексной терапии у детей с рецидивирующим герпесом возможно после острого периода заболевания. Выбор иммуномодулятора осуществляется индивидуально, желательно на основании данных иммунологического обследования. Согласно нашему опыту, эффективным в этом периоде является совместное применение с ацикловиром препаратов с двойным - противовирусным и иммуномодулирующим - эффектом: инозин, интерферон, индукторы интерферона. Кроме препаратов двойного действия при рецидивирующем герпесе используют такие растительные адаптогены, как препараты кошачьего когтя, эхинацеи, элеутерококка, женьшеня, родиолы розовой и прочие. На втором этапе лечения также проводят определение характера микробной колонизации носо-, ротоглотки и кишечника ребенка. В случае выявления дисбиоза проводят коррекцию микрофлоры организма ребенка с помощью пробиотиков.
III этап - лечение очагов вторичной бактериальной инфекции.
Производится санация всех очагов вторичной бактериальной инфекции, прежде всего, одонто-, тонзиллогенных, а также со стороны желудочно-кишечно тракта. Основное внимание врача на этом этапе лечения направлено на установление взаимодействия с врачами-специалистами - гастроэнтерологами, ЛОР-врачами и другими. В этот период целесообразно применять препараты, которые завершают санацию хронических очагов бактериальной инфекции и оказывают содействие в предупреждении возникновения интеркуррентных заболеваний, что в конечном итоге способствует уменьшению числа рецидивов ГВИ. К таким препаратам относятся бактериальные лизаты. После окончания лечения дети с рецидивирующим герпесом должны находиться на диспансерном учете и обязательно осматриваться врачом-педиатром в весенне-осенний период, когда значительно возрастает влияние факторов риска рецидива ГВИ (ухудшается эпидемическая ситуация относительно ОРВИ, возникают сезонные обострения хронических заболеваний, увеличивается антигенная нагрузка вследствие начала пребывания детей в детских коллективах и т.п.). Во время плановых осмотров определяют риск возникновения рецидива ГВИ и при наличии повышенного риска назначают курсы профилактического лечения, направленные прежде всего на нормализацию состояние иммунитета (растительные адаптогены, поливитамины). Таким детям также рекомендована обязательная вакцинация против гриппа.
Литература
1. Гранитов В.М. Герпесвирусная инфекция. М.:Медицинская книга (2001).
2. Греф Д. Педиатрия. М.:Практика (1997).
3. Иванова В.В. Инфекционные болезни у детей. М. МИА (2002).
4. Инфекционные болезни. Обзор Комитета по инфекционным болезням Американской Академии Педиатрии. Симферополь:Таврида (1993).
5. Кириленко І.І. Гевкалюк Н.О. Поєднані герпетичні та кандидозні ураження слизової оболонки порожнини рота у дітей // Вісник стоматології, №4 (1996).
6. Лещинская Е.В. Мартыненко И.Н. Острые вирусные энцефалиты у детей. М.:Медицина (1990).
7. Лысенко А.Я. Турьянов М.Х. Лавдовская М.П. ВИЧ-инфекция и СПИД-ассоциированные заболевания. М. ТОО "Рароть" (1996).
8. Мельник В.В. Зовиракс: специфическая химиотерапия герпетической инфекции // Український медичний часопис, №1 (1998).
9. Мельниченко Э.М. Клиника, лечение, прогнозирование и профилактика рецидивирующего герпетического стоматита у детей // Здравоохранение Белоруссии, №6 (1992).
10. Протоколы диагностики, лечения и профилактики внутриутробных инфекций у новорожденных детей.- М. ГОУ ВУНМЦ МЗ РФ (2001).
11. Савичук Н.О. Клініко-патогенетичне обгрунтування комплексного лікування хронічної кандидо-герпетичної інфекції слизової оболонки порожнини рота у дітей // Збірник наукових праць співробітників КМАПО ім. П.Л.Шупіка, Т.1 (1998).
12. Серов В.Н. Цитомегаловирусная инфекция в акушерстве и перинаталогии. М. (2000).
13. Тимченко В.Н. Инфекционные болезни у детей. СПб.:СпецЛит (2001).
14. Long S.S. Pickering L.K. Prober C.G. Pediatric Infectious Diseases. Churchill Livingstone Inc. New York, London, Madrid, Melbourne, San Francisco, Tokyo (1997).
15. Sarah S. Long, Larry K. Picnering Charles A. Prober.Prinsiples and Practice of Pediatric Infections Diseases. Churchill Livingstone Inc. (1997).
Ацикловир – инструкция: против герпеса и других вирусных заболеваний
Чувствительность к ацикловиру проявляют вирусы простого герпеса (в том числе вызывающего половой герпес), вызывающего ветряную оспу и опоясывающий лишай, а также цитомегаловирусы.
При кожных проявлениях герпеса ацикловир препятствует распространению сыпи, ускоряет присыхание пузырьков, снижает риск осложнений со стороны внутренних органов, уменьшает боль при опоясывающем лишае, оказывает иммуностимулирующий эффект.
После приема внутрь всасывается около пятой части дозы ацикловира. Он проникает в головной и спинной мозг, выделяется с женским молоком. Разлагается ацикловир в печени, после чего удаляется через почки, как в неизменном виде, так и в виде продуктов обмена.
Показания и противопоказания для применения
Ацикловир назначают при появлении самых первых признаков заболевания:
При приеме ацикловира рекомендуется употреблять больше жидкости – это предупредит отложение в почках солей (песка). Нанесение мази или крема рекомендуется проводить в перчатках для предупреждения распространения сыпи на другие участки тела.
Противопоказаниями для назначения ацикловира являются индивидуальная непереносимость препарата и кормление ребенка грудью. При беременности ацикловир назначается в том случае, когда предполагаемая польза для организма женщины превышает возможный риск для организма ребенка.
Не рекомендуется назначать ацикловир при тяжелых заболеваниях почек с нарушением их функции.
При приеме таблеток ациколвира: тошнота, рвота, понос, боли в животе, головная боль, головокружение, снижение работоспособности и концентрации внимания, галлюцинации, сонливость или бессонница, небольшое повышение температуры, сыпь на теле, облысение, преходящее нарушение функции печени и почек, снижение в крови числа лейкоцитов и эритроцитов.
При введении ацикловира внутривенно капельно, общие реакции: тошнота, рвота, острая почечная недостаточность из-за отложения в ткани почек кристаллов солей, песок (кристаллы солей) в моче, нарушения сознания, галлюцинации, возбуждение, дрожание конечностей, судорожная готовность, острые расстройства психики (психозы), сонливость или бессонница, кома на месте введения: воспаление кожи или стенок вен (флебит).
При местном применении глазной мази ацикловир: жжение и зуд в месте наложения мази, поверхностные воспалительные процессы.
При длительном наружном применении: в месте нанесения мази или крема жжение, зуд, сыпь, покраснение и сухость кожи с шелушением на слизистых оболочках – раздражение, которое сопровождается жжением и зудом.
Признаками передозировки ацикловира являются тошнота, рвота, понос, сильная головная боль, головокружение, одышка, острое нарушение функции почек, судороги, коматозное состояние. При появлении таких признаков нужно вызвать скорую помощь: лечение должно проводиться только в стационаре.
Ацикловир – это лекарственный препарат, который должен назначать только врач.
Современное лечение герпесвирусных инфекций человека. Противовирусные препараты
Специфические противовирусные препараты
Первым специфичическим противогерпетическим препаратом являлся ацикловир, за который компания-разработчик “Glaxo Smith Kline” получила Нобелевскую премию. По химической структуре ацикловир является ациклическим аналогом дезоксигуанозина, естественного компонента ДНК, где кольцевая структура сахара замещена ациклической боковой цепью (рис. 1). В результате такой модификации вирусная ДНК-полимераза воспринимает молекулу препарата в качестве субстрата для синтеза вирусной ДНК.
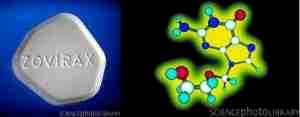
Рис. 1. Фото Зовиракса (первого препарата ацикловира) и изображение формулы молекулы действующего вещества
Являясь аналогом дезоксигуанозина, ацикловир должен пройти фосфорилирование для приобретения биологической активности. Собственно фосфорилирование происходит в три этапа с последовательным образованием ацикловирмоно-, ди- и трифосфата. При этом ключевым является именно первый этап фосфорилирования, осуществляемый вирусным ферментом тимидинкиназой . причём этот процесс происходит только в инфицированных клетках, что обеспечивает высокую степень избирательности действия ацикловира и низкую токсичность препарата. В результате ошибки вирусной ДНК-полимеразы ацикловиртрифосфат встраивается в полинуклеотидную цепь герпетической ДНК и прерывает дальнейших синтез молекулы, блокируя тем самым репродукцию вируса. Бесспорными преимуществами ацикловира являются его высокая избирательность и низкая токсичность, а недостатками – неодинаковая эффективность при различных герпетических инфекциях, воздействие только на реплицирующийся вирус и возможность формирования резистентности к препарату. Риск возникновения устойчивости к ацикловиру прямо пропорционален длительности приёма препарата и особенно часто встречается у иммунодефицитных больных . что обосновывает необходимость раннего подключения иммунотерапии . которая способна сократить требуемый срок использования противовирусного средства. Как указывалось выше, чувствительность различных герпесвирусов к ацикловиру существенно отличается. В порядке убывания чувствительности их можно расположить следующим образом: HHV-1, HHV-2, HHV-3 > HHV-4, HHV-5 > HHV-6, HHV-7. Таким образом, ацикловир наиболее эффективен при инфекциях, вызванных вирусами простого герпеса 1 и 2 типов, а также варицелла-зостер-вирусом, а наименее – при патологии HHV-6 и HHV-7 этиологии.
Отличия в чувствительности к ацикловиру обусловлены разным содержанием вирусной тимидинкиназы – у HHV-6 и HHV-7 количество такого фермента наиболее низкое, что обусловивает необходимость использования более высоких доз препарата. Ещё одним недостатком ацикловира является его низкая биодоступность, поскольку при пероральном приёме всасывается лишь около 15 % действующего вещества, а период полувыведения из плазмы крови составляет только 2,0-2,5 ч. Это создаёт необходимость частого приёма относительно высоких доз препарата (5-8 раз в сут по 200 – 800 мг), что существенно снижает комплаенс терапии. Несмотря на распространённый миф о токсичности, ацикловир обычно хорошо переносится больными, а побочные эффекты крайне редки.
В настоящее время разработано три стратегии лечения при помощи ацикловира :
1. Эпизодическая терапия . при которой используется препарат per os в дозе 200-400 мг 5 раз в сут (при рецидивах орофациального и генитального герпеса) либо 800 мг 5 раз в сут 5-10 сут (при эпизодах опоясывающего герпеса)
2. Длительная супрессивная терапия (от 6 мес. до 1 года и дольше) препаратом в дозе 400 мг 2 раза в сутки или 200 мг 4 раза в сутки per os при частых рецидивах локализованного кожно-слизистого герпеса (6 и более в 1 год), диссеминированном кожном герпесе, при редких, но тяжёлых рецидивах, а также при вторичных изменениях в психике, связанных с фобией очередного обострения (например, при так называемом менструальном генитальном герпесе)
3. Внутривенная терапия ацикловиром в дозе 5-10 мг/кг каждые 8 часов на протяжении 7-14 сут (для взрослых), которая используется в случае тяжёлых органных поражений, вызванных HHV-1, HHV-2 и HHV-3 (вирусный энцефалит. пневмонит, хориоретинит, гепатит и др.) новорождённым с генерализованной HHV-2 инфекцией препарат вводится в дозе 10 мг/кг 3 раза в сут 10-14 сут, а детям в возрасте от 3-х мес. до 12 лет – в дозе 250 мг/м 2 каждые 8 ч.
Валацикловир (валтрекс, валавир, вальтровир)представляет собой валиновый эфир ацикловира. Это так называемое пролекарство, которое превращается в действующее вещество ацикловир под влиянием кишечного и печёночного фермента валацикловир-гидроксилазы. За счёт модификации молекулы достигается повышение биоусвояемости препарата, которая выше, чем у ацикловира в 3-5 раз и составляет 54-70 %. Поэтому валацикловир можно использовать реже (2-3 раза в день), что делает терапию для больного более удобной. Препарат обычно хорошо переносится, побочные явления встречаются достаточно редко (рис. 2).
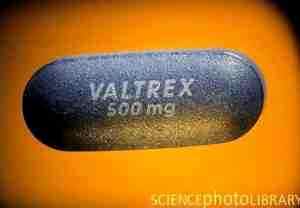
Рис. 2. Фото Валтрекса – наиболее часто используемого препарата валацикловира в мире
Фамцикловир (фамвир) по химической природе является диацетатом пенцикловира и относится к группе ациклических аналогов гуанозина. Хорошо всасывается в тонкой кишке и уже в кишечной стенке быстро превращается в активное соединение – пенцикловир (биоусвояемость составляет около 77 %). Период полужизни такой же, как и у ацикловира (2,5 часа). Механизм действия фамцикловира также аналогичен таковому у ацикловира и состоит в фосфорилировании до пенцикловир-трифосфата с участием вирусной тимидинкиназы и клеточных ферментов, встраивании в полинуклеотидную цепочку ДНК вируса и блокаде дальнейшего удлинения молекулы. Отличия состоят в более выраженной селективности по отношению к заражённым клеткам (тропность тимидинкиназы вируса в 100 раз выше к пенцикловиру, чем к ацикловиру) и в более длительном периоде внутриклеточной полужизни (7-20 часов по сравнению с 0,7-1 час у ацикловира). Поэтому эффективность терапии менее зависима от концентрации препарата в сыворотке крове, чем в случае лечения ацикловиром.
Препарат эффективен в лечении инфекций, вызванных HHV-1, HHV-2, HHV-3, Эпштейна-Барр вирусом, цитомегаловирусом и вирусом гепатита В. Важно отметить, что фамцикловир в некоторых случаях может быть использован в случае резистентности к ацикловиру. При оролабиальном и генитальном герпесе фамцикловир (фамвир) используется в дозе 250 мг 3 раза в день per os 7 дней, при опоясывающем герпесе – 250-500 мг 3 раза в день на протяжении 7-14 дней.
Ганцикловир (цимевен) – синтетический нуклеозидный аналог гуанозина. Механизм действия сходен с таковым у ацикловира, однако не требует активного участия вирусной тимидинкиназы. Поэтому препарат используется преимущественно при тех герпетических инфекциях, где недостаточно эффективен ацикловир (HHV-4, HHV-5, HHV-6, HHV-7). Существенным недостатком препарата является его сравнительно высокая токсичность . поэтому ганцикловир следует назначать строго по показаниям – при реактивированных формах указанных инфекций, которые приводят к тяжёлым органным поражениям. Как правило, лечение ганцикловиром проводят в два этапа – индукции и поддерживающей терапии. Во время первого этапа препарат назначают в/в из расчёта 5-7,5 мг/кг массы тела каждые 12 часов в течение 14 – 21 сут. Поддерживающая терапия состоит в назначении препарата в дозе 5 мг/кг каждые 24 ч ежедневно или 6 мг/кг каждые 24 ч 5 сут в неделю курсом 3 мес. В некоторых случаях допустимо проведение поддерживающего курса терапии при помощи пероральной формы ганцикловира – по 1 г каждые 8 ч 3 мес.
Валганцикловир – представляет собой валиновый эфир ганцикловира – пролекарство, которое превращается в ганцикловир после всасывания в кишечнике. Характеризуется более высокой биодоступностью . чем ганцикловир.
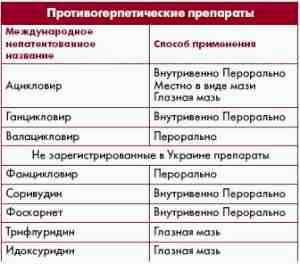
Фоскарнет (фоскавир) является ингибитором вирусной ДНК-полимеразы и в меньшей степени – РНК-полимеразы. При этом препарат связывается с пирофосфатом и частично ингибирует нуклеозидтрифосфат, что опосредует терапевтический эффект. Эффективен по отношению к HHV-1, HHV-5, HHV-6, HHV-7, однако сравнительно высокая токсичность несколько ограничивает широкое применение этого препарата (считается средством второго ряда). Препарат вводится в/в медленно в дозе 60 мг/кг 3 раза в сут 10-14 дней преимущественно при тяжёлых органных поражениях, вызванных указанными герпесвирусами (табл. 1).
Сейчас появились новые специфические противовирусные препараты такие как бривудин . по отношению к которым требуется дополнительное уточнение их эффективности и безопасности.
Также следует оговорить ещё 2 принципиальных положения, касающихся лечения при помощи специфических противовирусных препаратов:
Во-первых . у пациентов с иммунодефицитами следует в 2 раза увеличивать дозы противовирусных средств, так как у таких людей нарушена функция иммунного надзора, что обусловливает возрастание вирусной нагрузки, а также часто наблюдается резистентность вируса к рекомендованным препаратам (как правило, это результат ранее проводимой нерациональной противовирусной терапии).
Во-вторых . у пациентов преклонного возраста дозы противовирусных медикаментов следует корригировать согласно клиренсу креатинина, т.е. необходимо учитывать экскреторную функцию почек . Считается, что при клиренсе креатинина от 25 до 50 мл/мин показана обычная доза препарата каждые 12 часов, при клиренсе от 10 до 25 мл/мин – обычная доза каждые 24 часа, а при клиренсе до 10 мл/мин – половина обычной дозы каждые 24 часа сразу же после диализа.
Также следует уточнить, что у маленьких детей дозу противовирусного препарата лучше рассчитывать не на кг массы тела, а на единицу площади поверхности кожи.
Таблица 1. Лекарственные средства, применяемые при нейротропных герпесвирусных инфекциях
Источники:
, ,
Следующие:
27 июля 2024 года
Комментариев пока нет!

 Фимоз у мальчика 2 года
Фимоз у мальчика 2 года Нефропатия у детей диагностика
Нефропатия у детей диагностика Ацикловир акрихин детям до 3 лет
Ацикловир акрихин детям до 3 лет Побочное действие ацикловира для детей
Побочное действие ацикловира для детей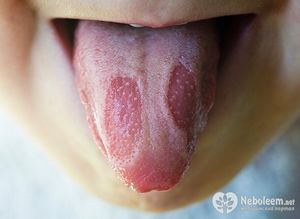 Болезнь стоматит у детей симптомы
Болезнь стоматит у детей симптомы Методы обучения детей с зпр физической культуре и их реализация
Методы обучения детей с зпр физической культуре и их реализация